IZ: 3.2 Die integralen Membranproteine
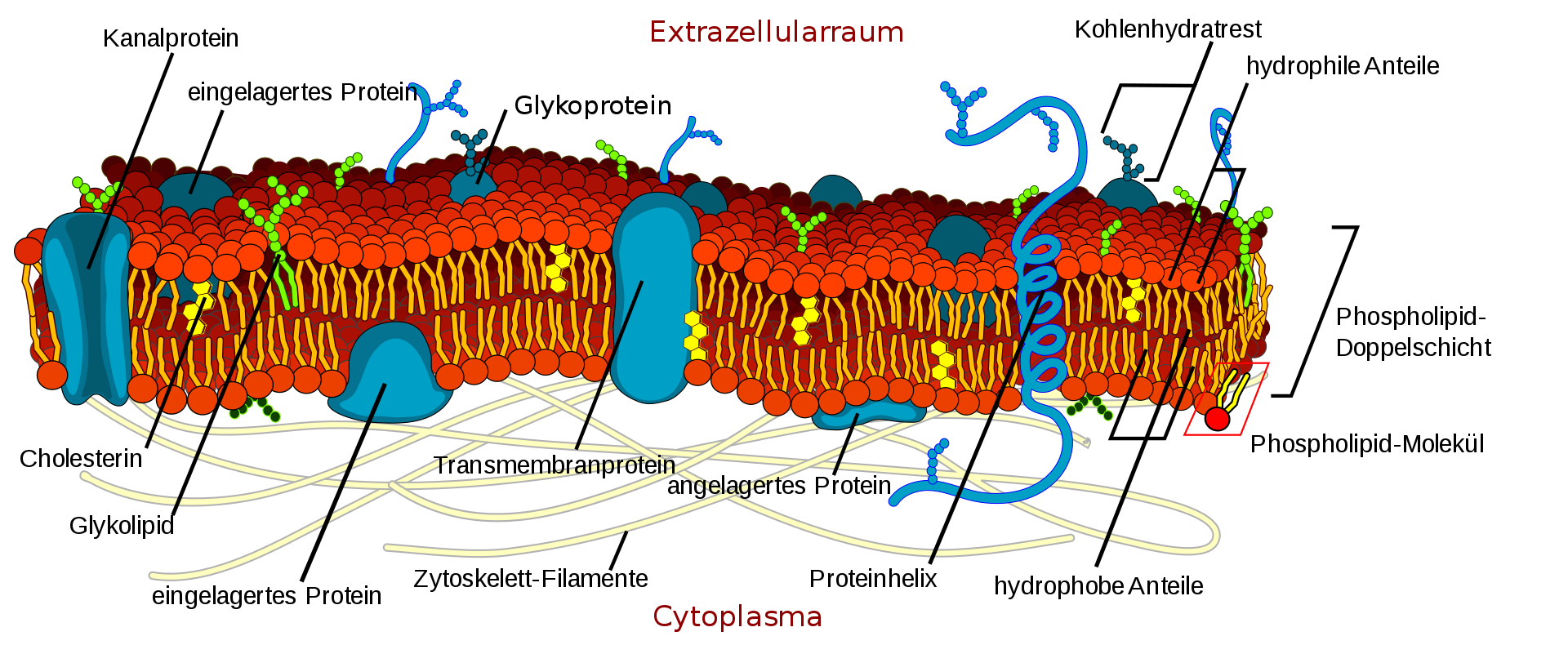
Die Oliven unseres Sandwichs sind der wirklich geniale Teil der Membran. Ihre Proteine erlauben nämlich, daß Nährstoffe, Abfallprodukte und andere Arten von »Informationen« durch die Membran transportiert werden können. Die Protein-»Oliven« lassen auch nicht wahllos alle Moleküle durch, sondern nur solche, die für die Funktion des Zytoplasmas wichtig sind. In meiner Sandwich-Analogie entsprechen die Oliven denintegralen Membranproteinen (IMPs). Diese Proteine sind wie die Oliven in der Abbildung in die »Butter«-Schicht der Membran eingebettet.

Aber wie halten sich die IMPs in der Butter? Wir erinnern uns, daß Proteine aus einem linearen »Rückgrat« miteinander verbundener Aminosäuren bestehen. Von den zwanzig verschiedenen Aminosäuren sind einige hydrophil (wasserliebend) und polar und andere hydrophob (wasserabstoßend) und unpolar. Wenn ein Bereich des Protein-Rückgrats aus aneinander gebundenen hydrophoben Aminosäuren besteht, findet dieser Abschnitt des Proteins eine stabile Bindung in einer fettigen Umgebung wie dem Lipidkern der Membran (siehe Pfeil). So kann sich der hydrophobe Teil des Proteins in die Mitte der Membran einbetten. Weil manche Bereiche des Protein-Rückgrats aus polaren Aminosäuren bestehen und andere Bereiche unpolar sind, webt sich der Protein-Strang in die Sandwichschichten ein.
Es gibt viele IMPs mit vielen verschiedenen Namen, die sich jedoch in zwei Funktionsgruppen einteilen lassen: in Rezeptorproteine und Effektorproteine. Rezeptor-IMPs sind die Sinnesorgane der Zellen, das Äquivalent unserer Augen, Nasen, Ohren, Geschmacksknospen etc. Die Rezeptoren funktionieren wie molekulare »Nano-Antennen«, die auf bestimmte Umweltsignale ausgerichtet sind. Manche Rezeptoren sind nach innen gerichtet, um das innere Milieu der Zelle zu überwachen, und andere nach außen, um auf externe Signale zu achten.
Wie bei anderen, bereits besprochenen Proteinen haben die Rezeptoren eine inaktive und eine aktive Form, und sie wechseln, ihrer Ladung entsprechend, zwischen diesen Konformationen hin und her. Wenn sich ein Rezeptorprotein an ein Umweltsignal bindet, bewirkt die daraus hervorgegangene Veränderung der elektrischen Ladung, daß das Rückgrat seine Form verändert und in eine »aktive« Konformation wechselt. Für jedes Umweltsignal, das sie ablesen müssen, haben die Zellen besonders ausgebildete Rezeptoren.
Manche Rezeptoren reagieren auf physische Signale. Ein Beispiel dafür ist der
Östrogenrezeptor, der genau darauf eingerichtet ist, der Form und Ladungsverteilung eines Östrogenmoleküls zu entsprechen. Wenn sich das Östrogen in der Nähe des Rezeptors befindet, dockt der Rezeptor daran an, so wie ein Magnet Stecknadeln einsammelt. Sobald sich der Östrogenrezeptor und das Östrogenmolekül so perfekt wie Schloß und Schlüssel miteinander verbunden haben, verändert sich die elektromagnetische Ladung des Rezeptors und das Protein wechselt in seine aktive Konformation. Auf die gleiche Weise entsprechen die Histaminrezeptoren genau der Form der Histaminmoleküle und die Insulinrezeptoren genau der Form der Insulinmoleküle und so weiter.Die »Antennen« der Rezeptoren können auch Schwingungsenergiefelder wie Licht, Klang und Radiowellen empfangen. Die Antennen dieser »Energie«-Rezeptoren vibrieren wie Stimmgabeln. Wenn in der energetischen Umgebung der Zelle eine Schwingung auftritt, die mit der Antenne des Rezeptors in Resonanz ist, so verändert sich die Ladung des Proteins und der Rezeptor verändert seine Form [Tsong 1989]. Darauf werde ich im nächsten Kapitel näher eingehen und will hier nur darauf hinweisen, daß die Annahme, nur physische Moleküle könnten auf die Zelle einwirken, hinfällig geworden ist.
Das biologische Verhalten kann durch unsichtbare Kräfte (unter anderem z.B. auch durch Gedanken) ebenso gesteuert werden wie durch physische Moleküle, beispielsweise Penicillin. Das ist der wissenschaftliche Hintergrund für die medikamentenfreie energetische Medizin.
Die Fähigkeiten der Rezeptormoleküle sind bemerkenswert, für sich allein aber
haben sie noch keine Auswirkungen auf das Verhalten der Zelle. Der Rezeptor ermöglicht der Zelle eine Wahrnehmung der Umweltsignale, doch muß die Zelle auf angemessene Weise reagieren. Das ist die Aufgabe der Effektorproteine. Gemeinsam bilden die Rezeptor- und Effektorproteine einen Wahrnehmungs- und Reaktionsmechanismus, der sich mit den körpereigenen Reflexen vergleichen läßt, die von Ärzten gerne geprüft werden. Wenn der Doktor mit dem Hämmerchen auf Ihr Knie klopft, nimmt ein sensorischer Nerv diesen Reiz auf und gibt die Information sofort an einen motorischen Nerv weiter, der das Bein in Bewegung versetzt. Die Rezeptoren der Membran entsprechen den sensorischen Nerven und die Effektorproteine entsprechen den handlungserzeugenden motorischen Nerven. Zusammen wirkt der Rezeptor-Effektor-Komplex wie ein Schalter, der Umweltsignale in Zellverhalten übersetzt. Erst in den letzten Jahren haben die Wissenschaftler die Bedeutung der IMPs in der Membran entdeckt. Sie ist so groß, daß sich daraus ein eigenes Forschungsgebiet entwickelte, die »Signaltransduktion« oder Signalübertragung. Die damit befaßten Wissenschaftler sind eifrig damit beschäftigt, Hunderte von Informationspfaden zu klassifizieren, die in der Membran zwischen der Wahrnehmung eines Umweltsignals und der Aktivierung der Verhaltensproteine liegen. Die Erforschung der Signaltransduktion katapultierte die Membran ins Rampenlicht der Forschung, so wie der Forschungsbereich der Epigenetik plötzlich die Chromosomenproteine ins Zentrum der Aufmerksamkeit gerückt hat.
Es gibt verschiedene Arten verhaltenssteuernder Effektorproteine, denn für einen reibungslosen Ablauf der Zellfunktionen müssen viele verschiedene Aufgaben erledigt werden. So gehört beispielsweise zu den Transportproteinen eine weitläufige Familie von Kanalproteinen, die Moleküle und Informationen von einer Seite der Membran auf die andere schaffen. Das bringt uns zu den paprikagefüllten Oliven in unserem Sandwich zurück. Viele Kanalproteine ähneln einem eng gewickelten Knäuel und entsprechen daher unseren paprikagefüllten Oliven (siehe Abbildung Seite 45 unten). Wenn die elektrische Ladung eines Proteins verändert wird, wechselt das Protein seine Form, wodurch mitten in dem Protein eine Öffnung entsteht. In gewissem Sinne können die Kanalproteine je nach ihrer elektrischen Ladung beide Arten von Oliven verkörpern. In ihrer aktiven Form entsprechen sie einer ungefüllten Olive und in ihrer inaktiven Form einer gefüllten Olive, welche die Zelle vor der äußeren Welt abschirmt.
Die Aktivität einer bestimmten Art von Kanalprotein, der Natrium-Kalium-ATPase, verdient besondere Aufmerksamkeit. Jede Zelle hat in ihrer Membran Hunderte dieser Kanäle. Gemeinsam benötigen sie für ihre Aktivität ungefähr die Hälfte des täglichen Energieverbrauchs unseres Körpers. Diese Kanäle öffnen und schließen sich so häufig, daß sie der Drehtür eines Kaufhauses im Schlußverkauf ähneln. Jedes Mal, wenn sich der Kanal »dreht«, befördert er drei positiv geladene Natriumatome aus dem Zytoplasma heraus und bringt dafür zwei positiv geladene Kaliumatome von draußen in das Zytoplasma hinein.
Die Natrium-Kalium-ATPase verbraucht nicht nur viel Energie, sie erzeugt auch selbst Energie, so wie gekaufte Batterien die Gameboys Ihrer Kinder antreiben – bis sie verbraucht sind. Eigentlich ist die energieproduzierende Aktivität der Natrium-Kalium-ATPase sogar sehr viel effektiver als die Batterien, denn sie macht aus der Zelle eine ständig sich wieder aufladende biologische Batterie.
Und hier ist ihr Trick: Bei jeder Drehung der Natrium-Kalium ATPase werden mehr positive Ladungen nach außen getragen als hereingebracht, und dies geschieht gleichzeitig in jeder Zelle bei Tausenden von Proteinen. Während diese Proteine jede Sekunde Hunderte von solchen Zyklen durchlaufen, lädt sich das Innere der Zelle negativ auf, während das Äußere positiv geladen ist. Die negative Ladung wird als Membranpotential bezeichnet. Natürlich läßt die Lipidschicht der Membran keine geladenen Atome durch, weshalb die Ladung im Zellinneren negativ bleibt. Die positive Ladung außerhalb und die negative Ladung innerhalb der Zelle machen aus ihr eine Art sich immer wieder selbst aufladender Batterie, deren Energie dann für biologische Prozesse zur Verfügung steht.
Eine andere Variante der Effektorproteine, die Zytoskeletalproteine, regulieren die
Gestalt und Beweglichkeit der Zellen. Eine dritte Variante namens Enzyme verbindet oder trennt Moleküle, weshalb sie von uns Menschen auch als Verdauungshilfen eingesetzt werden. In ihrer aktivierten Form können alle Effektorproteine, auch die Kanalproteine, die Enzyme und die Zytoskeletalproteine, mitsamt ihrer Nebenprodukte als Signale zur Aktivierung der Gene dienen. Die IMPs und ihre Nebenprodukte produzieren Signale, die auf die Verbindungen der Regulatorproteine in dem »Ärmel« um die DNS wirken. Im Gegensatz zur konventionellen Ansicht steuern die Gene also ihre Aktivität nicht selbst. Vielmehr sind es die Effektorproteine der Membran, die das »Ablesen« der Gene steuern, damit verbrauchte Proteine ersetzt oder neue erzeugt werden können.