2.1 Struktur des Wassers
- Siehe auch FT: Molekül Prozesse: Wasser
Titel: Literaturrecherche und Demonstrations-Experimente zur Anomalie Wasser
Wasser ist ein Element, dass uns in unserem Dasein auf der Erde ständig umgibt. Es kommt in der Natur unter Umgebungsbedingungen als einzige anorganische Verbindung in allen drei Aggregatzuständen vor (vgl. Gordalla, Müller & Frimmel, 2011, S. 31). In reiner Form, wie es durch Destillation hergestellt werden kann, findet man es jedoch nur im Labor. Verunreinigungen oder gelöste Stoffe im Wasser sind die Regel und beeinflussen sein Verhalten. Die chemische Struktur von Wasser stellt eine wichtige Grundlage dar, um seine speziellen Eigenschaften verstehen zu können. Deshalb ist die genaue Betrachtung des Wassermoleküls und seine Interaktion mit seiner Umgebung unumgänglich. Auf den nächsten Seiten werden die chemischen Eigenschaften von Wasser auf molekularer Ebene diskutiert.
2.1.1 Das Wassermolekül
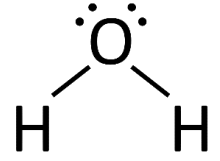
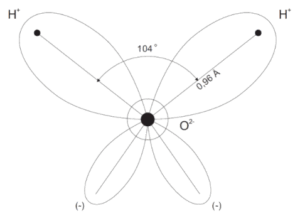
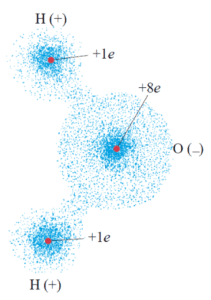
Ein Sauerstoffatom und zwei Wasserstoffatome bilden das dreiatomige Molekül Wasser (Abbildung 1). Nimmt man ein Periodensystem der Elemente zur Hand und sucht nach den beiden Elementen Wasserstoff (H) und Sauerstoff (O), stellt man fest, dass es sich hierbei um zwei Nichtmetalle handelt. Wasserstoff besitzt ein Elektron, Sauerstoff sechs Elektronen in der äußersten Schale. Jene Außenelektronen stehen für eine Bindung zur Verfügung. Im Fall von Wasser gehen die Elektronen der zwei Wasserstoffatome eine Bindung mit zwei Elektronen des Sauerstoffs ein, wobei der Bindungswinkel zwischen den Wasserstoffatomen etwa 104° beträgt (Abbildung 2). Diese Form der chemischen Bindung von Nichtmetallen ist als Elektronen-Paarbindung oder kovalente Bindung bekannt (vgl. Neumüller, 1979, S. 662–668). Um eine solche kovalente Bindung in einem Vielteilchensystem aber erst möglich zu machen, ist ein Gleichgewicht der unterschiedlichen Coulomb-Wechselwirkungen nötig. Die abstoßende Kraft ist hierbei die elektromagnetische Kraft zwischen den positiven Atomkernen, die anziehende Kraft die Austauschwechselwirkung der Elektronen. Für das Verständnis dieser Austausch-Wechselwirkung ist es notwendig, einen Schritt in die Quantenmechanik zu setzen.
2.1.1.1 Kovalente Bindung
Um das Verständnis zu erleichtern, wird erstmals die Bindung von zwei Wasserstoffatomen herangezogen, welche gemeinsam ein Wasserstoffmolekül bilden. Da das Prinzip dieser Bindung auch bei anderen kovalenten Bindungen sehr ähnlich ist, sollte dies hier vorerst genügen. Werden die beiden Wasserstoffatome einander genähert, beginnen sich deren Elektronenwellenfunktionen zu überlagern. Jedes Elektron erfährt nun die elektromagnetische Anziehung beider Atomkerne.
Nach dem Pauli-Prinzip, das in einem Quantenzustand die Unterscheidung mindestens einer Quantenzahl eines Elektrons fordert, sind im Grundzustand (n = 1) zwei Spin-Anordnungen der Elektronen möglich: parallel oder antiparallel ausgerichtete Spins. Parallel ausgerichtete Spins führen zu einem Gesamtspin S = 1, antiparallele Spins zu S = 0 (vgl. Giancoli, 2009, S. 1369).
Sind beide Spins nach oben oder beide nach unten ausgerichtet (parallel, S = 1), so ist es nach dem Pauli-Prinzip nicht möglich, dass sich beide Elektronen im niedrigsten Energiezustand n = 1 befinden, wenn sie nur einem Atom zugeordnet sind. Die Elektronen würden in diesem Fall im Grundzustand eines Wasserstoffatoms identische Quantenzahlen besitzen. Damit zwei Elektronen mit den gleichen Quanteneigenschaften das Pauli-Prinzip nicht verletzen, müssen sie sich also an unterschiedlichen Orten aufhalten. In unserem Fall wären jene verschiedenen Orte die zwei Wasserstoffatome. Werden nun die beiden H-Atome einander genähert, bleiben die Elektronen
voneinander entfernt. Nach dem Coulomb-Gesetz stoßen sich die beiden positiv geladenen Atomkerne gegenseitig ab und es kommt im Fall S = 1 zu keiner Bindung. Die in Abbildung 3 ersichtliche Wahrscheinlichkeitsverteilung der Elektronen soll dies visualisieren.
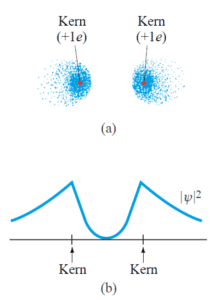
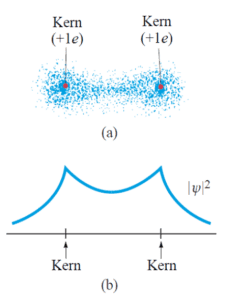
Abbildung 3: Wahrscheinlichkeitsverteilung der Elektronen (Elektronenwolke) zweier Wasserstoffatome, wenn die Spins gleich sind (S = 1): (a) Elektronenwolke; (b) Projektion von |ψ|2 entlang des Querschnitts durch die Mittelpunkte beider Atome. (Giancoli, 2009, S. 1369)
Abbildung 4: Wahrscheinlichkeitsverteilung der Elektronen zweier Atome bei entgegengesetzt ausgerichteten Spins (S = 0): (a) Elektronenwolke; (b) Projektion von |ψ|2 entlang des Querschnitts durch die Mittelpunkte beider Atome. In diesem Fall kommt es zu einer Bindung, weil die beiden positiv geladenen Kerne von der zwischen ihnen liegenden negativen Ladungskonzentration angezogen werden. Dies ist ein Wasserstoffmolekül, H2. (Giancoli, 2009, S. 1370)
Wird der zweiten Fall S = 0 betrachtet, bei dem die Elektronenspins antiparallel angeordnet sind, so verletzen die Elektronen bei räumlicher Näherung nicht das Pauli-Prinzip. Sie unterscheiden sich nämlich geforderter Weise in einer Quantenzahl, dem Spin. In Abbildung 4 ist wieder die Wahrscheinlichkeitsverteilung der beiden Elektronen dargestellt. Man erkennt nun, dass die Elektronen einen großen Anteil ihrer Zeit zwischen den beiden positiv geladenen Kernen verbringen. Diese negativ geladene Elektronenwolke zwischen den Kernen zieht sie gegenseitig an. Genau jene Anziehung, durch welche die Atome zusammengehalten werden und somit ein Molekül bilden können, macht die Eigenschaften der kovalenten Bindung aus. Die in Abbildung 3 und 4 dargestellten Wahrscheinlichkeiten der Wellenfunktionen |ψ|2 machen die Forderung des Pauli-Prinzips noch deutlicher. Sind die Spins der Elektronen im Bereich zwischen den Atomkernen gleich, kommt es zur destruktiven Interferenz der Wellenfunktionen der beiden Elektronen wie in Abbildung 3 (b). Dies bedeutet, dass die Aufenthalts-Wahrscheinlichkeit der Elektronen im Gebiet, in welchem destruktive Interferenz beobachtet werden kann, minimal ist. Jenes Gebiet mit der geringsten Aufenthaltswahrscheinlichkeit repräsentiert hier den Bereich zwischen den Atomkernen. Halten sich also keine Elektronen zwischen den Kernen auf, so kommt es zu keiner Näherung der Kerne. Im Gegenteil, die beiden positiv geladene Kerne stoßen sich durch die Coulomb-Wechselwirkung ab und es kommt zu keiner Bindung (vgl. Giancoli, 2009, S. 1369–1370).
Sind die Elektronenspins im Gegensatz dazu gegeneinander ausgerichtet, kommt es im Bereich zwischen den Atomen zu konstruktiver Interferenz der Wellenfunktionen (Abbildung 4 (b)). Dies gibt Aufschluss über eine große Aufenthaltswahrscheinlichkeit der negativ geladenen Elektronen zwischen den Atomkernen. Durch diese negative Ladungskonzentration ergibt sich die elektrostatische Anziehung der beiden positiv geladenen Kerne. Zusammengefasst lässt sich also sagen, dass die kovalente Bindung als ein Ergebnis konstruktiver Interferenz der Wellenfunktionen der Elektronen im Bereich zwischen den Atomen aufgefasst werden kann. Letztlich sollte noch erwähnt werden, warum Atome überhaupt Bindungen eingehen, um Moleküle zu bilden. In diesem Beispiel ist ein Wasserstoffmolekül stabiler, weil die Gesamtenergie des Moleküls geringer ist als die Energie der beiden getrennten Wasserstoffatome. Da Systeme immer den niedrigsten möglichen Energiezustand anstreben, begeben sich Atome in solche Bindungen. Deshalb ist zur Trennung des Wasserstoffmoleküls in zwei Wasserstoffatome Energie notwendig, welche genau der Bindungsenergie entspricht (vgl. Giancoli, 2009, S. 1369–1370).
2.1.1.2 Bildung asymmetrischer Moleküle
Mit diesem Wissen bezüglich der Molekülbindung wird nun das Wassermolekül genauer unter die Lupe genommen. Rein kovalente Bindungen kommen meist nur bei rein symmetrischen Molekülen, wie z. B. bei Wasserstoff, vor. Da Wasser aber aus unterschiedlichen Atomen besteht, halten sich die gemeinsam genutzten Elektronen wahrscheinlicher bei einem Atom auf als beim anderen. Dies ist auf Eigenschaften der ionischen Bindung zurückzuführen. Jene hängt von der Elektronenkonfiguration der verschiedenen Atome ab und verlagert die Elektronenwellenfunktion räumlich. Dies bedeutet, dass die Elektronen zwischen den Atomen ungleichmäßig aufgeteilt sind und unterschiedlich stark gemeinsam genutzt werden. Bei Wasser handelt es sich um eine
sogenannte kovalente Bindung mit teilweise ionischem Charakter. Die Wassermoleküle selbst sind polar, sie haben also ein elektrisches Dipolmoment. Dieses Dipolmoment kommt dadurch zustande, dass die Molekülkomponenten unterschiedliche Nettoladungen tragen. Im Fall von Wasser wären die getragenen Nettoladungen der Wasserstoffe positiv, die des Sauerstoffs negativ (siehe Abbildung 5). Um zu verstehen wie diese unterschiedlichen Nettoladungen zustande kommen, muss die Elektronenkonfiguration der bindenden Atome genauer betrachtet werden.
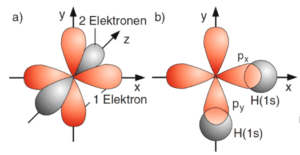
Bei der kovalenten Bindung mit teilweise ionischem Charakter des Wassermoleküls halten sich die gemeinsam genutzten Elektronen mit größerer Wahrscheinlichkeit in der Nähe des Sauerstoffatoms auf. Der Grund dafür ist die Elektronenkonfiguration des Sauerstoffs. Jener besitzt acht Elektronen, die in Orbitalen wie folgt angeordnet sind: 1s² 2s² 2p4 (vgl. Giancoli, 2009, S. 1371). Die vier Valenzorbitale des Sauerstoffs, welche für die Bindung berücksichtigt werden müssen, sind 2s, 2px, 2py und 2pz. Die beiden Elektronen des 1s Sauerstofforbitals sind nicht an der Molekülbindung beteiligt und müssen deshalb nicht berücksichtigt werden. Die Elektronen-Konfiguration in den Valenzorbitalen lautet 2s², 2px, 2py, 2pz2. Für die Bindung des Sauerstoffatoms mit den beiden Wasserstoffatomen sind also nur zwei ungepaarte Elektronen verfügbar. Eines der beiden Elektronen hält sich im 2px, das andere im 2py Orbital auf (siehe Abbildung 6: Die drei 2p-Orbitale des O-Atoms. Das graue pz -Orbital ist mit 2 Elektronen besetzt. (b) Bindung zwischen den 1s-Orbitalen der H-Atome und den 2px -, 2py -Orbitalen des O-Atoms (Demtröder, 2010, S. 338)
Das Elektron des Wasserstoffatoms muss dabei einen antiparallelen Spin besitzen, um das Pauli-Prinzip nicht zu verletzen. Durch diese Bindung entsteht eine große Elektronendichte zwischen dem Sauerstoff und den Wasserstoffatomen, was wie bei der kovalenten Bindung bereits diskutiert wurde, wesentlich für die Molekülbindung ist. Wie in Abbildung 6 (b) ersichtlich, überlappen die 1s Orbitale der Wasserstoffmoleküle mit den 2px und 2py Orbitalen des Sauerstoffatoms. Wie auch beim Wasserstoffmolekül führt diese Überlappung zu einer geringeren Gesamtenergie und somit schließlich zur Bindung (vgl. Demtröder, 2010, S. 337).
2.1.1.3 Polarität
Die Verteilung der Nettoladungen ergibt sich aus der Besetzung der Orbitale. Die beiden voll besetzten kugelsymmetrischen Orbitale 1s und 2s beschreiben vier der acht Elektronen des Sauerstoffatoms und sind in Bezug auf die Nettoladungen nicht weiter relevant. Die freibleibenden Orbitale 2px und 2py des Sauerstoffs bieten Platz für die zwei Elektronen der Wasserstoffatome und ziehen diese mit einer Nettoladung von +4e an. Natürlich ziehen auch die Wasserstoff-Atomkerne die Elektronen an, sodass sie sich teilweise um den Sauerstoff und teilweise um die Wasserstoffatome bewegen. Durch diese Flexibilität bezüglich der Aufenthaltsorte gibt es an beiden Wasserstoffatomen eine positive Nettoladung. Diese Nettoladung beträgt weniger als +1e, weil die Elektronen nur einen zeitlichen Anteil dort verbringen. Die Elektronen der Wasserstoffatome halten sich jedoch viel wahrscheinlicher in der Nähe des Sauerstoffatoms auf und es entsteht am Sauerstoff ein Überschuss an negativen Ladungen (vgl. Giancoli, 2009, S. 1369–1372). Genau diese gegebenen Verteilungen der Nettoladungen bestimmen eine ganz wesentliche Eigenschaft des Wassers: seine Polarität. Wasser besitzt eine Elektronegativitäts-Differenz von ΔχW = 1,4 resultierend aus der Elektronegativität von Sauerstoff mit χ = 3,5 und Wasserstoff mit χ = 2,1. Damit ist seine Polarität im Vergleich zu dem sehr ähnlichen Molekül Schwefelwasserstoff (H2S) mit einer Elektronegativitätsdifferenz von ΔχS = 0,4 sehr groß. Dies hat mitunter einen großen Einfluss auf die weiteren diskutierten Eigenschaften von Wasser.
2.1.1.4 Bindungswinkel
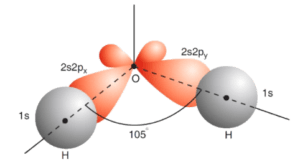
Letztlich stellt sich noch die Frage nach dem Bindungswinkel des Wassermoleküls. Betrachtet man die Orbitale in Abbildung 6 (b) würde man meinen, dass die Wasserstoffatome in einem Winkel von 90° zu einander stehen müssen. Jedoch beträgt der experimentell festgestellte Bindungswinkel beim Wassermolekül zwischen 104° und 105°. Dies kommt durch die Wechselwirkung der Elektronen des Sauerstoffatoms und der Wasserstoffatome zustande, welche die Elektronenhüllen der Atome verformt. Darum besitzt das 2s Orbital des Sauerstoffs nicht länger eine kugelsymmetrische Form, sondern ist durch die Linearkombination der 2s und 2p Orbitale gegeben
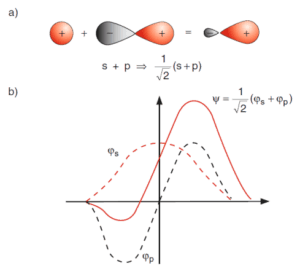
(Abbildung 7). Durch diese veränderte Elektronenverteilung kommt es zur Verlagerung des Ladungs-Verteilungsschwerpunkts und zu einer größeren Überlappung der Elektronen-Wellenfunktion ψ mit der 1s-Funktion des Wasserstoffatoms wie in Abbildung 7 b) dargestellt.
Dies wirkt sich wiederum positiv auf die Bindung zwischen Sauerstoff und Wasserstoff aus. Die erwähnte Linearkombination der 2s und 2p Orbitale kann wie folgt beschrieben werden:
φ(2s) Elektronenwellenfunktion 2s Orbital von Sauerstoff
φ(2p) Elektronenwellenfunktion 2p Orbital von Sauerstoff
c1, c2 Koeffizienten
ψ Linearkombination der Elektronenwellenfunktionen 2s und 2p
Die Koeffizienten ci werden hierbei so variiert, dass die Bindungsenergie zwischen den Atomen maximal wird, also die Gesamtenergie minimiert wird. Der optimale Anteil der p-Funktion kann somit bestimmt werden. Solche kombinierten Orbitale werden auch als Hybridorbitale bezeichnet
𝜓 = 𝑐1 · 𝜑(2𝑠) + 𝑐2 · 𝜑(2𝑝) (1)
und sind durch ihre nicht mehr im rechten Winkel zueinanderstehenden Bindungen charakterisiert. Beachtet man beim Wassermolekül also alle Polarisations- und Austauscheffekte, so erhält man tatsächlich auch theoretisch den experimentellen Bindungswinkel von 105° (Abbildung 8) (vgl. Demtröder, 2010, S. 337–338). Hier sollte noch angemerkt werden, dass in den meisten Lehrbüchern Bindungswinkel zwischen 104° und 105° angegeben werden. Diese kleine Ungereimtheit ergibt sich dadurch, dass die Geometrie des Wassermoleküls, aufgrund der unterschiedlichen Rotations- und Vibrationszustände des Moleküls sowie seiner Umgebung, leicht variiert (vgl. Palmer, 2004, S. 2).
2.1.2 Wasserstoffbrücken
Wasserstoffbrücken spielen eine Schlüsselrolle, wenn man sich auf die Suche nach Gründen für die speziellen Eigenschaften des Wassers macht. Die Ladungsverteilung und Geometrie des Wassermoleküls führt dazu, dass benachbarte Wassermoleküle dazu neigen sich in eine tetraedrische Anordnung mit ihren Nachbarmolekülen zu begeben. Wie schon der Name vermuten lässt, sind bei der Wasserstoffbrückenbindung zwingend Wasserstoffatome involviert. Der Sauerstoff ist partiell negativ geladen, oft mit δ− bezeichnet, und die Wasserstoffatome sind partiell positiv geladen, oft mit δ+ bezeichnet. Die Wasserstoffatome ordnen sich zwischen die Sauerstoffatome der benachbarten Wassermoleküle und bilden zwischen den unterschiedlichen Partialladungen Wasserstoffbrücken aus. Jedes Wassermolekül besitzt somit vier bis fünf Nachbarn, wobei von jedem Wassermolekül drei bis vier Wasserstoff-Brückenbindungen ausgehen.
Dies erzeugt eine gerichtete Wechselwirkung zwischen den Molekülen von 12 kJ/mol pro gebildeter Wasserstoffbrücke (vgl. Ludwig & Paschek, 2005). Zum Vergleich: Die Energie starker Bindungen (kovalente und ionische Bindung innerhalb der Moleküle) liegt im Bereich von 200 kJ/mol bis 500 kJ/mol. Jene schwache, zwischenmolekulare Wechselwirkung ist zwar deutlich schwächer als die starke chemische Bindungsenergie, jedoch viel stärker als die wechselwirkenden Kräfte einer reinen Van-der-Waals-Bindung (vgl. Giancoli, 2009, S. 1376). Wann und wie oft Wasserstoffbrücken gebildet werden, hängt vom Aggregatzustand des Wassers und somit von der Temperatur. Die tetraedrische Struktur ist in Eis nahezu perfekt, im flüssigen Wasser wird sie mit
steigender Temperatur immer geringer. Trotzdem existieren Wasserstoffbrücken auch bei sehr hohen Temperaturen oberhalb des kritischen Punkts Tk = 374,15 °C bei einem Druck von pk = 22 MPa (vgl. Wernecke, 2003, S. 19). Bei einer Temperatur von 400 °C bei 40 MPa sind noch 29 % der Wasserstoffbrücken, im Vergleich zur ursprünglichen Anzahl bei Raumtemperatur und Normaldruck, vorhanden. Bei 500 °C und 43 MPa sind es noch 13 %. Das ist auch der Grund, warum sich die lösenden Eigenschaften von Wasser bei Temperaturen jenseits von Tk deutlich verändern (vgl. Palmer, 2004, S. 151–152). Ab dem kritischen Punkt kann zwischen flüssiger und gasförmiger Phase nicht mehr unterschieden werden. Man spricht hier von überkritischem (oder superkritischem) Wasser. Durch die geringere Anzahl an Wasserstoffbrücken im überkritischen Zustand, wird die Polarität (siehe 2.1.1.3) von Wasser deutlich verringert und es können auch normalerweise nicht wasserlösliche Stoffe, wie z. B. Lacke, gelöst werden. Somit bietet überkritisches Wasser eine billige und ungiftige Alternative zu konventionellen Lösungsmitteln. Einzig die benötigten hohen Drücke erweisen sich in der Praxis noch als problematisch (vgl. Weitze, 2006). Ein Beispiel für eine einzelne Wasserstoffbrücke ist die Bindung von zwei H2O-Molekülen zu (H2O)2-Dimeren (Abbildung 9).
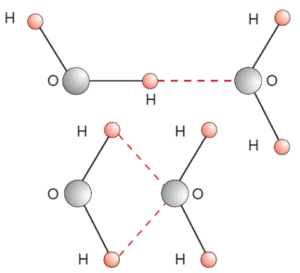
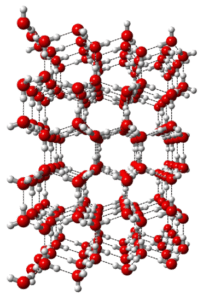
In Abbildung 10 ist eine hexagonale Anordnung von Wassermolekülen dargestellt, die einen Eiskristall bilden. Die Wasserstoffbrückenbindung ist für die Bildung der Dimere von (H2O)2 in Wasser und die signifikante Struktur von Eis verantwortlich (vgl. Demtröder, 2010, S. 431). Bei hexagonalem Eis ist die tetraedrische Anordnung der Wassermoleküle unendlich fortgesetzt. Der
Bindungswinkel der Wassermoleküle beträgt für tetraedrische Konfigurationen übliche 109,5° (vgl. Gordalla et al., 2011).Ganz anders als beim Eis verhalten sich die Wasserstoffbrücken in flüssigem Wasser. Die Wassermoleküle sind nicht wie im Eis in Sechserringen angeordnet, sondern die häufigste Ringkonfiguration besteht aus fünf Molekülen. Wie in Abbildung 11 dargestellt sind manche Molekülenden nicht gebunden. Es bildet sich also ein dynamisches Netz aus Wasserstoffbrücken mit vier (sehr selten fünf) Bindungen pro Molekül. Durch diese ungleichmäßigere Anordnung als in der festen Phase, können die Moleküle auch Plätze in den Zwischenräumen der Ringstrukturen einnehmen. Damit kann flüssiges Wasser eine höhere Dichte als Wasser im festen Zustand erlangen, was allgemein für Flüssigkeiten sehr ungewöhnlich ist (vgl. Ball & Reuter, 2002, S. 224–225).
Philip Ball versucht dies wie folgt bildlich zu erklären:
Computermodelle flüssigen Wassers zeigen, dass die mit Wasserstoffbrücken hergestellte Vernetzung zufällig und ungeordnet ist und sich in der Art eines verrückten Klettergestells durch die Gesamtheit der Moleküle zieht. Hier wird das Netz als Gerüst von Streben wiedergegeben, die die Wasserstoffbrücken zwischen Molekülen darstellen. Die Sauerstoffatome der Moleküle sitzen an den Verbindungsstellen der Streben. (Ball & Reuter, 2002, S. 224)
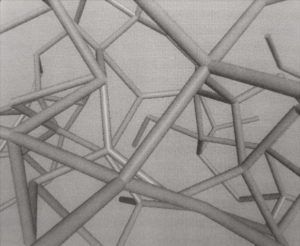
Welche genauen Rollen die Molekülanordnung und Wasserstoffbrücken für die Aggregatzustände, die Dichteanomalien, den relativ hohen Siedepunkt und die Kohäsion von Wasser spielen, wird auf den folgenden Seiten noch genauer diskutiert.
Impressum